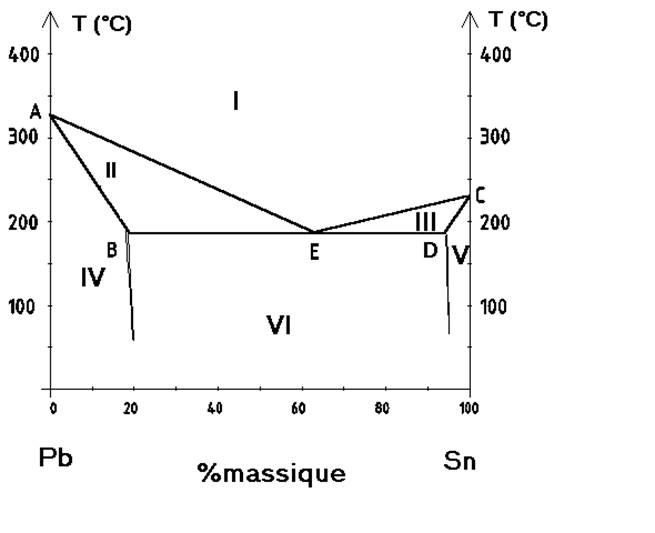
On considère le diagramme binaire solide liquide du système étain-plomb donnée sur la figure ci-dessous.
1)- a ) Quelle de la nature de la miscibilité entre l’étain et le plomb ?
b) Donner la signification des points A, B, C, D et E.
c) Indiquer la nature des phases dans les différents domaines.
2 ) On refroidit 100g d’un mélange liquide à 40% en masse d’étain jusqu’à l‘ambiante.
a) Tracer et commenter la courbe de refroidissement de ce mélange.
b) Déterminer la nature, la composition et la quantité des phases obtenues à
une température de 225°C.
Masse atomique Sn : 118,6
Extrait : Epreuve de Chimie Minérale PC2 Juin 2003
NIVERSITE CADI AYYAD Faculté des Sciences- Semlalia Marrakech
Corrigé
![]()